الان قادریم دیانای را ویرایش کنیم. اما بیاید عاقلانه انجامش دهیم
متن سخنرانی :
چند سال پیش، همراه همکارم، امانوئل شارپنتیر فناوری تازهایی برای اصلاح ژنومها اختراع کردم . به اسم CRISPR-Cas9. فناوری CRISPR به دانشمندان اجازه میدهدتغییراتی در دیانای سلولها ایجاد کنند تا قادر باشیم امراض ژنتیکی را درمان کنیم.شاید علاقمند باشید بدانید که CRISPR چطور از یک پروژهتحقیقی ابتدایی که هدفش کشف چگونگی مبارزه باکتریها با عفونتهای ویروسی بود به اینجا ختم شد. باکتریها باید با ویروسها درمحیطشان سروکار داشته باشند، و ما میتوانیم به عفونت ویروسی بعنوان یکبمب ساعتی نگاه کنیم-- باکتری پیش از نابودیتنها چند دقیقه برای خنثی کردن بمب زمان دارد. خب اکثر باکتریها در سلولهایشان سیستم ایمنی تطابق پذیری به اسم CRISPR دارند، که آنها را قادر به کشفدیانای ویروسی و بعد نابودیشان میکند.
بخشی از سیستم CRISPR پروتینی به اسم Cas9 است، که قابلیت جستجو، برش زدن و سرانجام استحاله دیانای ویروسی را به روشی خاص دارد. و از طریق تحقیق ما برای فهمیدن فعالیت این پروتئین Cas9 بود که فهمیدیم قادر به مهاراین کارکرد بعنوان یک فناوری مهندسی ژنتیک هستیم-- روشی برای دانشمندان جهت حذف یا وارد کردنتکههای خاص دیانای به درون سلولها با دقتی باور نکردنی-- که فرصتهایی را برای انجام کارهایی که واقعا در گذشته غیرمحتمل بودند، فراهم میکند.
فناوری CRISPR همین حالا هم برای تغییر دیانای در سلولهای موشها و میمونها و دیگر موجودات نیز استفاده میشود. اخیرا دانشمندان چینی نشان دادند که آنها حتی توانستهاند از فناوری CRISPR برای تغییرات ژنی در جنین انسان استفاده کنند. و دانشمندان در فیلادلفیا نشان دادند که آنها میتوانند از CRISPR برای برداشتن دیانای از یک ویروس اچآیوی ادغام شده از سلولهای انسان مبتلا استفاده کنند.
فرصت انجام این چنین ویرایشهای ژنومی البته منجر به بروز مسائل اخلاقی متعددمیشود که نیاز به بررسی دارد، زیرا این فناوری را نه تنها میتوان در سلولهای بالغ بکار برد، بلکه قابلیت بکارگیری درجنین جانوران را نیز دارد، از جمله ما انسانها. و خب همراه با همکارانم به یک فراخوان جهانی درباره فناوریکه یکی از مخترعین آن هستم دعوت شدهام، تا بتوانیم همه پیامدهای اخلاقی و اجتماعی فناوری مثل این را بررسی کنیم.
آنچه میخواهم الان انجام دهم این است که به شما بگویم فناوری CRISPR چیست، چه کارمیتواند انجام دهد، امروز کجای کار هستیم و این که چرا فکر میکنم لازم است مسیر حساب شدهای را در نحوه بکارگیری این فناری اتخاذ کنیم.
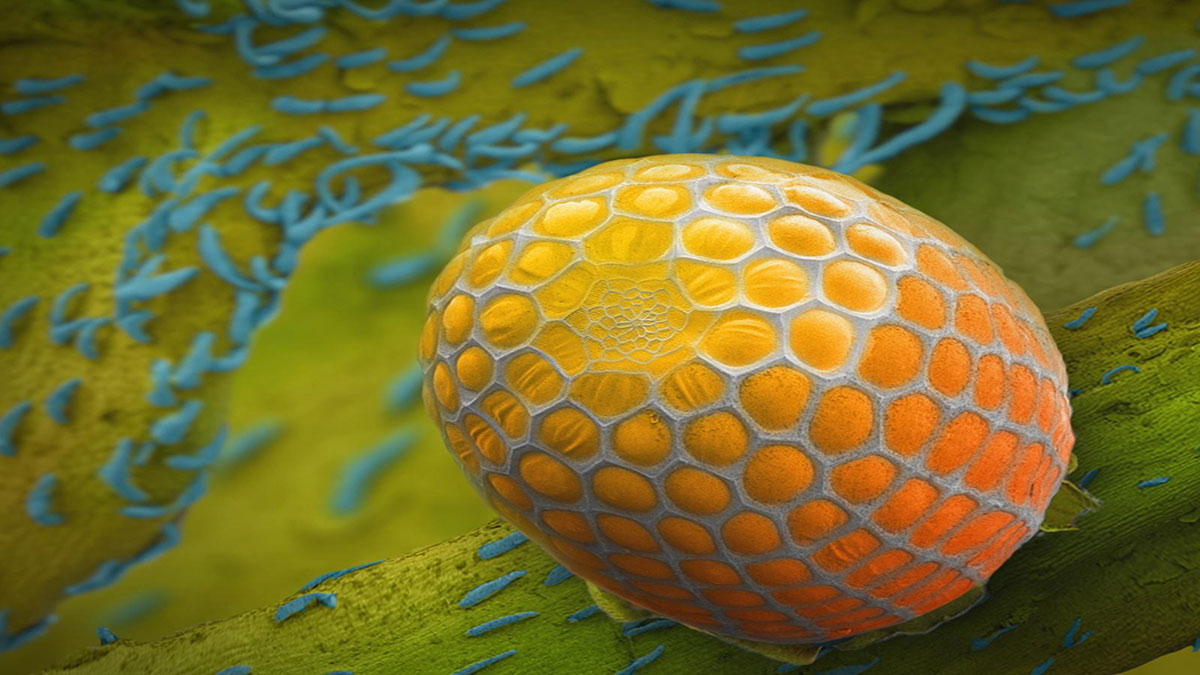
وقتی ویروسها سلولی را آلوده میکنند،به دیانایشان نفوذ میکنند. و در یک باکتری، سیستم CRISPR دیانای را قادر میسازد آن ویروس را بیرون براند، و در تکههای کوچک توی کروموزوم قرار گیرد--- دیانای باکتری. و این تکههای یکپارچه شده دیانای ویروسیتوی محلی به اسم CRISPR جا میگیرند. CRISPR مخفف تناوبهای کوتاه پالیندرومفاصلهدار منظم خوشهای است. (خنده)
حسابی دهن پرکن است-- برای همین است که از مخفف CRISPR استفاده میکنیم. راهکاری که به سلولها اجازه میدهد در طول زمان به ثبت ویروسهای بپردازند که در معرضشان بودهاند. و از همه مهمتر، آن تکههای دیانایبه نتاج سلولها منتقل میشوند. بنابراین سلولها نه تنها در یک نسلبلکه طی نسلها زیادی از ویروسها محافظت میشوند. سلولها این امکان را مییابندکه سابقه عفونت را ثبت کنند، و آنطور که همکارمبلیک وایدنفت دوست دارد بگوید، ژنگاه CRISPR کارت واکسیناسیون موثریدر سلولهاست. هنگامی که آن تکههای دیانای در داخل کوموزم باکتریایی قرار داده میشوند، سلول کپی کوچکی از مولکولی به اسم RNA را میسازد، که در عکس نارنجی است، و برگردان دقیقی از دیانای ویروسی است. RNA عموزاه شیمیایی دیانای است، و اجازه فعل و انفعال با مولکولهایدیانای را میدهد که توالی مشابهای دارد.
پس این تکههای کوچک RNAاز ژنگاه CRISPR با پروتئینی به اسم Cas9یکپارچه میشود-- بهم وصل میشوند-- که در تصویر سفید است، و مجموعهای را شکل میدهد که به نگهبان توی سلول میماند. توی کل دیانای سلول را میگردد تا محلهایی را بیابد که با توالیها در RNAهای بهم متصل سازگار است. و وقتی آن محلها یافت میشوند-- هانطور که در اینجا میبینید،مولکول آبی دیانای است-- این مجموعه با دیانای یکپارچه شده و به ساطور Cas9 اجازه قطع کردن دیانای ویروسی را میدهد. برشی بسیار دقیق است. پس میتوانیم به Cas9 RNAبعنوان مجموعه ساطوری فکر کنیم مثل قیچی که دیانای را میتواند ببرد-- در هلیکس دیانای شکست دو رشتهای ایجاد میکند. و از همه مهمتر این مجموعه قابل برنامهریزی است، بنابراین میتواند طوری برنامهریزی شودکه توالهای خاص دیانای را تشخیص دهد، و در آن محل در دیانای شکستگیایجاد کند.
همانطور که الان برایتان خواهم گفت تشخیص دادیم که آن فعالیت را میتوان برای مهار کردن مهندسی ژنوم بکار برد تا سلولها بتوانند تغییر بسیاردقیقی را در دیانای در محلی که این شکستگی معرفی شدهایجاد کنند. مانند همان نوع قیاسگری در روشی که برای پروسه پردازش کلمات جهت تصیح اشتباه املائیدر اسناد استفاده میشود.
دلیلی که ما استفاده از سیستم CRISPR را برای مهندسی ژنوم در نظر گرفتیم بخاطر این است که سلولها قابلیت شناسایی دیانای خراب و تعمیر آن را دارند. پس وقتی سلول گیاه یا حیوانی دچار قطعدورشتهای در دیانای آن میشود، میتواند آن شکست را تعمیر کند، خواه از طریق چسباندن انتهای دیانایها منقطع بهم با یک تغییر جزیی و کوچک یا تعمییر شکستگی با یکپارچهسازی تکه تازهای از دیانای در محل قطع شدن. پس اگر روشی برای معرفی شکستگیهای رشتههای دوگانه به داخل دیانای در محلهای دقیق داشته باشیم، قادر به برانگیختن سلولها برای تعمیر آن شکستگیها خواهیم بود، خواه از طریق شکاف یا همکاری اطلاعات ژنتیکی جدید. پس اگر قادر به برنامه ریزیفناوری CRISPR در شکستن دیانای باشیم در نزدیکی یا محلی که برای مثل جهش منجرشده به فیبروز سیستیک رخ داده، قادر به برانگیختن سلولها برای تعمیر آن جهش هستیم.
مهندسی ژنوم راستش چیز تازهای نیست،از دهه ۱۹۷۰ در حال پیشرفت بوده. ما فناوریهایی برای توالی دیانای داشتهایم، برای کپی کردن دیانای، و حتی برای دستکاری دیانای. و این فناوریها بسیار نویدبخش بودند، اما مشکل ناکارآمدی آنها بود، یا این که برای بکارگیری زیادی سخت بودند، طوریکه بیشتر دانشمندان از بکارگیری آنها در آزمایشگاهایشان یا قطعا در بسیار استعمالهای کلینیکی خودداری کردند. بنابراین، فرصت بکارگیری فناوری مثلCRISPR و استفاده از آن جذابیت دارد، چون نسبتا ساده است. فناوریهای مهندسیژنوم قدیمیتر درست مشابه این است که کامپیوترتان راهر باری که قصد اجرای نرم افزاری جدید را دارید،از نو سیم کشی کنید. فناوری CRISPR مثل نرم افزار برای ژنوم است، به راحتی قادریم با بکار گیریاین ذرههای کوچک دیانای آن را برنامه ریزی کنیم.
پس وقتی قطعدورشتهای در دیانای اتفاق میافتد، میتوانیم تعمیر را القاء کنیم، و بدان وسیله به دستاوردهایبالقوهای برسیم، مثل داشتن قابلیت اصلاح جهشهاییکه باعث کم خونی مدیترانهای یا بیماری هانتینگتون میشود. من راستش فکرمیکنم که اولین کاربردهای فناوری CRISPR در خون اتفاق بیفتد، جاییکه رساندن این ابزار به درون سلولهانسبتا آسان است، در مقایسه با بافتهای جامد.
هم اکنون، این کار بیشتر روی الگوهای حیوانی بیماری انسان انجام میشود،از قبیل موشها. از این فناوری برای انجام تغییرات بسیار دقیقی انجام میشود که به ما اجازه مطالعه نحوه تاثیراین تغییرات در دیانای سلولها را میدهد خواه بر روی یک بافت،و در این مورد روی کل اندام.
حال در این مثال، از فناوری CRISPR برای قطع کردن یک ژن استفاده میشود یعنی از طریق انجام تغییری کوچک در دیانای در ژنی که مسئول رنگ سیاه پوشش این موشهاست. تصورش را کنید که این موشهای سفید از هم تولههای رنگدانهدارشان متقاوت هستند آنهم بواسطه یک تغییر جزیی در ژنکل ژنومشان، و غیر از این کاملا عادی هستند. و هنگام توالی دیانایاین حیوانات، پی میبریم که تغییر در دیانای درست در جایی اتفاق افتاده کهدر آنجا القاء کردیم، با استفاده از فناوری CRISPR.
آزمایشهای اضافی روی بقیه حیواناتهمچنان جریان دارد، که برای خلق الگوهایی برای بیماری انسانمفیدند، برای مثال میمونها. و در اینجا پی میبریم که قادر به استفاده از این سیستمها برای تست کردن کابرد این فناوریدر بافتهای خاص هستیم، برای مثال، پی بردن به نحوه بکار گیریابزار CRISPR توی سلولها. ما همچنین مایلیم به درک بهتری از نحوه کنترل روشی برسیم که دیانای بعد از برش تعمیر میشود، و همینطور بفهمیم چطور میتوان هر نوع تاثیر ناخواسته یا دور از هدف بواسطه استفادهاز این فناوری را مهار کرد.
فکر میکنم شاهد کاربرد کلینکی اینفناوری خواهیم بود، قطعا در بزرگسالان، ظرف ۱۰ سال آینده. فکر میکنم که این احتمال هستشاهد آزمایشات کلینکی و شاید حتی تداویهای تایید شدهدر آن زمان باشیم، که فکرش هم بسیار هیجانانگیز است. و بخاطر هیجان موجود درباره این فناوری، علاقمندی بسیاری از سوی شرکتهاینوپای کسب و کار دیده میشود که برای تجاری کردن فناوریCRISPRتاسیس شدهاند و بسیاری از سرمایهگذاران کارآفرین که در این شرکتها سرمایهگذاری میکنند.
اما باید همچنین در نظر داشته باشیم که فناوری CRISPR را میتوان برایچیزهایی مثل بهسازی استفاد کرد. تصور کنید که میتوانیم مهندسی انسانهاییرا امتحان کنیم که خصیصههای تقویت شده دارد،از قبیل استخوانهای محکمتر، یا آسیب پذیری کمتردر برابر امراض قلبی یا حتی داشتن ویژگیهایی که شاید تمایل به داشتنش قابل ملاحظه باشد، مثل رنگ چشم متفاوت،یا قد بلندتر و چیزهایی مثل این. "طراحی انسانها،" اگر مایل باشید. امروز، اطلاعات ژنتیکی برای فهمیدن انواع ژنهایی کهمنجر به این خصیصهها میشوند تقریبا نامعلوم است. اما مهم است بدانیم فناوری CRISPR ابزار لازم را برای چنینتغییراتی به ما میدهد، زمانی که اطلاعات در دسترس باشد.
این مساله منتهی به مطرح شدن سوالات اخلاقی میشود که باید دربارهشان بادقت باشیم، و بهمین خاطر است که من و همکارانم خواستار مکثی جهانی در هر گونه کاربرد کلینکی در بکارگیری فناوری CRISPR در جنین انسان هستیم تا زمان داشته باشیم به بررسی دقیق انواع پیامدهای حاصلاز انجام این کار بپردازیم. و در واقع، نمونه مهمی از چنین درنگی به دهه ۱۹۷۰ برمیگردد، زمانی که دانشمندان با هم یکی شدند تا خواستار دیرکرد قانونی در استفاده ازهمتاسازی مولکولی شوند تا مادامیکه ایمنی آن فناوری با دقت آزمایش میشد و به تایید میرسید.
با این که انسانهای با ژنوم مهندسی شدههنوز با ما نیستند، اما دیگر جزی از داستانهای علمی تخیلی محسوب نمیشوند. همین الان گیاهان و حیواناتیرا داریم که ژنومشان مهندسی شده. و این اتفاق مسئولیت عظیمیرا پیش روی ما قرار میدهد تا با دقت به بررسی پیامدهای غیرعمدی و تاثیرات عمدی یک پیشرفت علمیبپردازیم.
متشکرم.
(تشویق)
(پایان تشویق)
برونو گیوسانی: جنیفر، همانطور که اشاره کردی این فناوری با پیامدهای عظیم است. طرز نگرش تو درباره درخواست برای لحظهای مکث، ضرب الاجل یا قرنطینه بطزر باورنکردنی پاسخگوست. البته نتایج درمانی هم دارد اما خب نتایج غیر درمانی هم دارد و به نظر میاید که آنها هستند که دچار انقباض میشوند، بویژه در رسانه. این یکی از نسخههای اخیر اکونومیست است--«ویرایش بشریت». به کل درباره افزایش ژنتیکی است،درباره تداوی نیست. با چه نوع واکنشهایی از سوی همکارانتان در جهان علم از سوی همکارانت مواجه شدی، وقتی ازت پرسیده میشدیا پیشنهاد میدادند که آیا واقعا باید برای لحظهای درنگ کنیم و درباره این کار فکر کنیم؟
جنیفر دودنا: همکارانم راستش فکر میکنماز فرصت پیش آمده برای بحث صریح سر این موضوع خوشحال بودند. جالبه وقتی با مردم صحبت میکنم، همکاران دانشمندم و سایرین، نقطه نظرات مختلف گستردهایدرباره این دیدگاه است. خب این موضوعی هست که نیاز به بحث و بررسی دقیق دارد.
ب گ: جلسه بزرگیدر دسامبر برگزار میشود که فراخوانی است از سوی شما و همکارنتان، همراه با آکادمی ملی دانشمندان و دیگران، در عمل توقع چه چیزیرا از این نشست دارید؟
ج د: خب، امیدوارم که بتوانیم شنونده دیدگاههایی مختلف از اشخاص و سازمانهای ذینفع بسیاری باشیم که میخواهند درباره مسئولیتنحوه استفاده از این فناوری فکر کنند. شاید رسیدن به یک دیدگاه موافق کلی ممکن نباشد اما فکر میکنم باید حداقلبه این درک برسیم که با چه مسائل در حین پیشرویمان مواجه خواهیم شد.
ب ج: الان، همکارانت، مثل جرج چرچ برای مثال در هاروارد، ادعا میکنند: «که بله، مسائل اخلاقی اساسا دغدغه ایمنی دارند. آنها را به دفعات روی حیوانات و درآزمایشگاهها تست میکنیم، و وقتی که حس کنیم بحد کافی ایمن است،روی انسانها منتقل میکنیم.» پس آن نوعی طرز تفکر دیگر است، که یعنی ما باید در واقع از این فرصتاستفاده کنیم و دنبالش برویم. آیا در اینجا با شکافی احتمالی درجامعه علمی مواجهایم؟ منظورم این است که شاهد خواهیم بودبرخی افراد بخاطر داشتن دغدغههای اخلاقی پا پس بکشند و برخی دیگر همینطوررو به جلو پیشروی کنند چون برخی کشورها تحت نظارت هستند یا برخی دیگر خیر؟
ج د: خب، فکر میکنم با هر فناوری جدیدی بخصوص مثل این، دیدگاههای متعددی وجود دارد و فکر میکنم کاملا قابل درک است. فکر کنم سرآخر، این فناوری برای مهندسی ژنوم انساناستفاده خواهد شد، اما فکر میکنم که انجام آنبدون بررسی و بحث لازم درباره خطرات و پیامدهای بالقوه مسئولانه نباشد.
ب گ: کلی فناوریها و رشتههای علوم دیگری هست که اندازه رشته شما پیشرفت نمایی دارند. دارم به هوش مصنوعی، رباطهای خودکارو غیره فکر میکنم. هیچکدام به نظر نمیرسند-- جدا از رباطهای جنگ طلب خودکار-- کسی به نظر نمیرسد که بحث مشابهایرا در آن رشتهها شروع کرده باشد که فراخوانی برای دیرکرد است. آیا به نظرت این بحث میتواندپیش زمینهی رشتههای دیگر باشد؟
ج د: خب، فکر میکنم برای دانشمندان بیرون آمدن از آزمایشگاه دشوار است. از طرف خود میگویم، کمی کار برایم ناخوشایند است. اما همینطور فکر میکنم که دخیل بودن در این تکوین من و همراهانم را واقعا در جایگاه مسئول قرار میدهد. و باید بگویم که واقعا امیدوارم که دیگر فناوریها هم به همان ترتیب ملاحظه شوند، درست همانطوری که ما میخواهیم پیامدهای احتمالی چیزی را علاوه بر زیست شناسی در دیگر رشتهها بررسی کنیم.
ب گ: جنیفر از این که به TED آمدی ممنونم.
ج د: متشکرم.
(تشویق)